DRUG4-COXPD1
Generación de terapias y biomarcadores para el tratamiento de enfermedades neurodegenerativas impulsadas por disfunción mitocondrial
LINEA DE ACTUACIÓN 3: PLATAFORMA DE CRIBADO DE FÁRMACOS Y ANÁLISIS INTERACCIONES FÁRMACO-DIANA
Línea de actuación complementaria: LA4. Desarrollo de modelos biológicos para cribado y estudio de la actividad de moléculas terapéuticas.
Palabras clave: COXPD1, mitocondria, neurodegeneración, biomarcadores
Coordina: Institut de Recerca Biomèdica (IRB Barcelona)
Participa: Vall d’Hebron Institut de Recerca (VHIR) (Cataluña), Hospital Sant Joan de Déu (SJD) (Cataluña), Universidad de Zaragoza (UNIZAR) (Aragón)
Persona de contacto: Dr. Antonio Zorzano (antonio.zorzano@irbbarcelona.org)
RESUMEN PROYECTO
La creciente incidencia de enfermedades neurodegenerativas representa un gran desafío cuya comprensión requiere enfoques multidisciplinarios. Los trastornos neurodegenerativos incluyen un grupo heterogéneo de enfermedades caracterizadas por la pérdida progresiva de neuronas. La consecuencia clínica es la pérdida de funciones motoras, sensoriales y cognitivas previamente adquiridas. Los mecanismos por los cuales se desarrollan diversas condiciones neurodegenerativas aún no se comprenden completamente. Cada vez hay más evidencias que sitúan a la disfunción mitocondrial como clave en el desarrollo y la progresión de diversas formas de neurodegeneración. En este proyecto, planeamos identificar terapias eficaces en el tratamiento de una enfermedad mitocondrial específica que causa hepatoencefalopatía, llamada COXPD1. Esta enfermedad es causada por mutaciones en el gen nuclear GFM1 que codifica para el factor de elongación de la traducción mitocondrial G1 (EFG1). No existe tratamiento para esta enfermedad y los pacientes a menudo fallecen durante los primeros meses de vida.
El proyecto implicará la realización de tres actividades interrelacionadas:
a) Búsqueda de terapias a través del cribado en fibroblastos humanos con una biblioteca de 50,300-200,000 compuestos para revertir las alteraciones impulsadas por las mutaciones de GFM1, seguido de la delineación de un camino preclínico.
b) Generación de un estudio de terapia génica que mejore el daño cerebral en un modelo de ratón de COXPD1
c) Identificación de biomarcadores en plasma mediante metabolómica en pacientes con COXPD1, con el fin de monitorear el estado de la enfermedad y la respuesta a los medicamentos.
En conjunto, proponemos una investigación transformadora que permitirá la generación de terapias y biomarcadores en condiciones de disfunción mitocondrial secundaria a mutaciones de GFM1.
RESULTADOS DEL PROYECTO
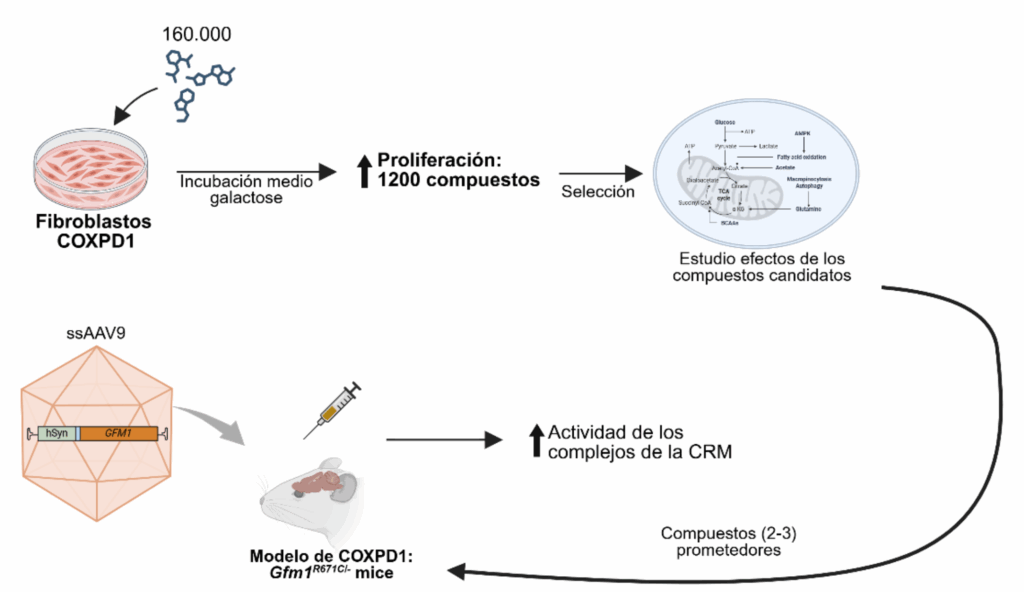
A lo largo del proyecto se desarrollaron dos líneas experimentales orientadas a abordar la patología mitocondrial COXPD1, causada por mutaciones en el gen GFM1.
La primera línea se centró en la generación de fibroblastos inmortalizados derivados de pacientes, con el objetivo de utilizarlos en un cribado de aproximadamente 160.000 compuestos químicos, llevado a cabo en la plataforma de cribado del IRB. El propósito de esta estrategia era identificar compuestos capaces de revertir la disminución en la proliferación celular inducida por el reemplazo de glucosa por galactosa como fuente energética en el medio de cultivo. Esta caída en la proliferación celular se debe a la deficiencia respiratoria característica de los fibroblastos de pacientes con COXPD1. Aproximadamente 1.200 compuestos mostraron capacidad para aumentar la proliferación celular, de los cuales más del 50 % fueron validados mediante un método alternativo basado en microscopía de fluorescencia. Como siguiente paso, se seleccionarán los compuestos más prometedores para evaluar en detalle sus efectos sobre los fibroblastos derivados de pacientes.
Paralelamente, se desarrolló una estrategia de terapia génica utilizando vectores AAV9P31 portadores del gen humano GFM1, bajo el control de promotores neuronales (SYN1) y ubicuos (EF1α). La prueba de concepto se realizó en un modelo murino KI/KO para Gfm1, mediante administración sistémica del vector en animales de seis semanas de edad. Se trataron 17 ratones con el vector terapéutico y 16 con vehículo, comparándolos con controles salvajes (WT). Cuatro semanas después de la inyección, se observó una transducción cerebral efectiva, con expresión detectable de la proteína GFM1 humana y restauración funcional de los complejos I y IV del sistema OXPHOS. Estas mejoras se confirmaron mediante western blot y ensayos de actividad enzimática, así como por la reversión parcial de respuestas mitocondriales compensatorias previamente observadas en el modelo murino.
COORDINA:

PARTICIPA:


