Nace el proyecto NANOTHERA-PET con el objetivo de superar las limitaciones y aumentar la viabilidad del tratamiento con radiofármacos contra el glioblastoma, uno de los tumores cerebrales más comunes y agresivos. Este proyecto, liderado por Galicia y con la colaboración de instituciones de Cataluña, busca desarrollar radiofármacos INMUNO-PET nanoencapsulados para superar la barrera hematoencefálica en el cerebro.
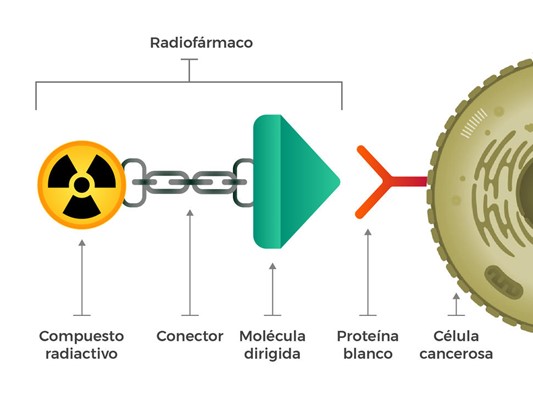
Los radiofármacos son uno de los mejores ejemplos de sinergia dentro de la medicina nuclear. Aunque una molécula y un isótopo, vistos individualmente, presenten ciertas limitaciones en el uso como tratamientos oncológicos; en conjunto representan una de las herramientas más valiosas en el diagnóstico y tratamiento de tumores y otros problemas de salud.
Así, los radiofármacos se definen como compuestos radiactivos formados por la unión de una molécula biológica normal, como puede ser una proteína o un aminoácido, con un isótopo o átomo radioactivo. Se caracterizan por poder actuar sobre órganos, tejidos o células concretas del cuerpo humano, detectando problemas de salud latentes en alguna de esas estructuras, o ejerciendo como piezas clave en el tratamiento. En definitiva, se trata de una técnica emergente que ha tenido un gran éxito, sobre todo, en el tratamiento de diversos tipos de cáncer, como el mieloma, el cáncer de pulmón o el urológico, por permitir llevar a cabo un tratamiento localizado y menos agresivo con los tejidos sanos colindantes que la radioterapia.
ISÓTOPOS Y MEDICINA NUCLEAR
Pero ¿cómo funcionan exactamente? Para actuar de manera eficiente y presentar buenos resultados, el átomo radioactivo debe ligarse a moléculas complejas específicas y dirigidas, normalmente necesarias para el crecimiento y desarrollo del tumor y poco interesantes para las células sanas. Así, el fármaco (isótopo + molécula) introducido en el cuerpo del paciente – ya sea por vía oral o venosa – viaja por el organismo hasta ser absorbido en gran medida por las células tumorales, las cuales “ingieren” la molécula y, con ella, el radioisótopo, haciendo visible el tumor y al liberar partículas radiactivas que ayudarán a su detección o, en el mejor de los casos, tratarán de eliminarlo.
Ahora bien, el tipo de isótopo ligado a la molécula biológica dependerá completamente del objetivo médico. Por ejemplo, si el radiofármaco tiene fines de diagnóstico, se elegirán isótopos emisores de radiación gamma, es decir, de fotones, los cuales son inofensivos para el organismo, pero poseen una alta capacidad de penetración, haciéndolos detectables desde el exterior y, por tanto, permitiendo detectar la existencia de tumores. Por otro lado, si el uso del radiofármaco se produce con el objetivo de tratar un cáncer ya conocido, se utilizarán átomos radioactivos que liberan radiación de alta energía, es decir, partículas alfa o beta que actuarán directamente sobre el tumor, destruyéndolo y debilitándolo.
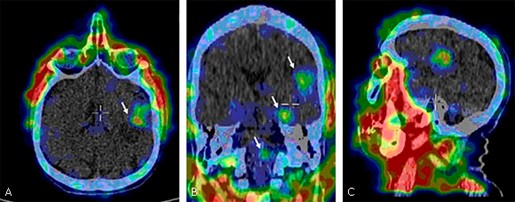
No obstante, a pesar de ser una técnica que ha revolucionado por completo los tratamientos tumorales gracias a su emisión altamente dirigida y controlada, presenta algunos desafíos que limitan su eficacia en algunos casos. Uno de ellos es la existencia de ciertas barreras fisiológicas en el organismo que pueden llegar a impedir la llegada de elementos grandes – tal y como los resultantes de la unión del isótopo y la molécula – a ciertas zonas del cuerpo. El mayor ejemplo de esto es la actuación de la barrera hematoencefálica (BHE) en el tratamiento de tumores cerebrales con radiofármacos: la barrera, una red de vasos sanguíneos y tejidos que regulan el paso de sustancias al encéfalo, suele limitar el paso de radiofármacos debido a su tamaño y su composición, detectando el isótopo como un elemento “añadido” y “desconocido”.
NANOTHERA-PET: LA LUCHA CONTRA EL GLIOBASTOMA
Con el objetivo de superar esas limitaciones y aumentar la viabilidad del tratamiento con radiofármacos nace el proyecto NANOTHERA-PET, el cual es liderado por investigadores de la Universidad de Santiago de Compostela (USC) y con la participación del Instituto de Investigación Sanitaria de Galicia (IDIS), la Universidad de Vigo (UVigo), el Instituto de Oncología Vall d’Hebron (VHIO) y el Institut de Reserca Vall d’Hebron (VHIR), como parte del Plan Complementario de Biotecnología Aplicada a la Salud en Galicia.
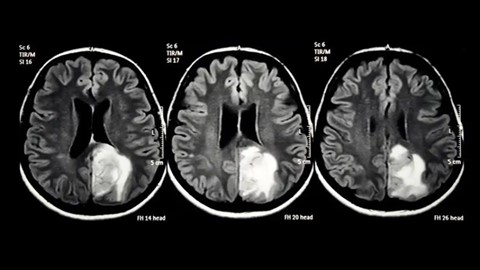
Este proyecto tiene como objetivo conseguir que los radiofármacos superen exitosamente la barrera hematoencefálica mediante el uso de nanoportadores funcionalizados. En otras palabras, diseñará, desarrollará y validará radiofármacados de tipo INMUNO-PET nanoencapsulados, tanto para diagnóstico como para tratamiento.
Bajo esa línea de actuación, NANOTHERA-PET medirá la farmacocinética y la biodistribución de anticuerpos dirigidos a proteínas EGFRVIII del gliobastoma multiforme, uno de los tumores cerebrales más agresivos y comunes. En otras palabras, los investigadores involucrados se centrarán en estudiar el comportamiento de los radiofármacos que, una vez en el tumor, serán absorbidos por las proteínas de las células tumorales, evaluando así cual es la mejor forma de evitar la BHE y permitir al radiofármaco alcanzar el gliobastoma.
Para ello, en primer lugar, se evaluarán diferentes nanoportadores, observando la eficacia de cada uno de ellos a la hora de atravesar la barrera hematoencefálica. A continuación, para aquellos nanoportadores seleccionados como candidatos, se realizará una prueba de capacidad para observar si son bien recibidos y absorbidos por las proteínas de la célula tumoral, algo imprescindible para el éxito del radiofármaco. Finalmente, solo aquellos más prometedores serán ligados al isótopo, en este caso 17Lu, para la administración de una dosis de radiación terapéutica a las células tumorales.












