FANCONI-CURE
Medicina de precisión para combatir la anemia de Fanconi
LINEA DE ACTUACIÓN 3: PLATAFORMA DE CRIBADO DE FÁRMACOS Y ANÁLISIS INTERACCIONES FÁRMACO-DIANA
Línea de actuación complementaria: LA4. Desarrollo de modelos biológicos para cribado y estudio de la actividad de moléculas terapéuticas
Palabras clave: Anemia de Fanconi, Cura, Cribado de alto rendimiento
Coordina: Institut de Recerca Sant Pau
Participa: Institut de Recerca Contra la Leucèmia Josep Carreras (IJC) (Cataluña), Universidad de Sevilla (Andalucía)
Persona de contacto: Jordi Surrallés Calonge (JSurralles@santpau.cat)
RESUMEN PROYECTO
La anemia de Fanconi (AF) es un trastorno genético raro causado por mutaciones en uno de los 23 genes Fanconi conocidos. La AF se caracteriza por fallo medular, malformaciones y predisposición al cáncer. La única cura de los síntomas hematológicos es el trasplante hematopoyético. La supervivencia post-trasplante está limitada por complicaciones de éste, así como la aparición prematura de cáncer oral y anogenital. La terapia génica representa una técnica prometedora para evitar el fallo medular, pero no reduce el riesgo de cáncer. Entre los pacientes con mutaciones en el gen FANCA, muchos expresan una proteína no funcional que no es capaz de translocarse al núcleo para ejercer su función. Éste es el caso de la mutación Phe1263del, presente en el 20-30% de los pacientes AF-.
Con el objetivo de descubrir una cura, planeamos realizar un cribado de alto rendimiento para encontrar un fármaco que facilite la translocación de FANCA al núcleo en un modelo celular con la mutación Phe1263del que también expresa YFP-FANCD2. En ausencia de daño en el DNA, FANCD2 se localiza normalmente en el núcleo visualizándose como un marcaje difuso, mientras que cuando FANCD2 se monoubiquitina forma focos nucleares intensos. En una línea celular deficiente en FANCA, FANCL no es capaz de monoubiquitinar FANCD2 y FANCD2 se observa como un marcaje nuclear difuso, aunque se expongan las células a daño. La monoubiquitinación de FANCD2 y su localización en focos nucleares se puede analizar por inmunofluorescencia adaptada a cribado de fármacos de alto rendimiento. Planeamos estudiar 5000 fármacos aprobados por la FDA, así como fármacos que se encuentren en ensayos clínicos (fases I y II), lo cual permitiría una translación clínica más rápida vía designación de medicamento huérfano y la consiguiente autorización de ensayos clínicos académicos. Un fármaco capaz de restablecer la monoubiqutinación de FANCD2 en presencia de p.Phe1263del a su vez restablecería su capacidad de formar focos nucleares. Conviene remarcar que un 20-50% de actividad reparadora del DNA parece ser suficiente para prevenir el fallo medular en pacientes con AF con mutaciones hipomórficas. Consecuentemente, un fármaco capaz de conseguir un nivel mínimo de reparación podría proporcionar un importante beneficio clínico.
RESULTADOS DEL PROYECTO
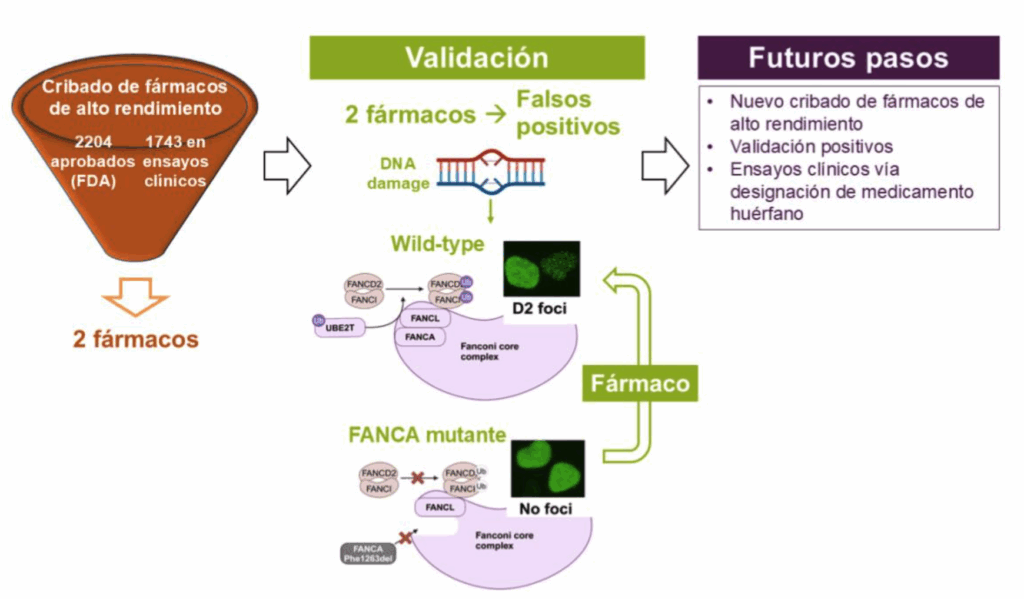
Medicina de precisión para combatir la anemia de Fanconi La anemia de Fanconi es un trastorno genético raro causado por mutaciones en uno de los 23 genes Fanconi, que se caracteriza por fallo medular, malformaciones y predisposición al cáncer. La única cura de los síntomas hematológicos es el trasplante hematopoyético, aunque su supervivencia está limitada por complicaciones de éste y la aparición prematura de cáncer. Entre los pacientes con mutaciones en FANCA, muchos expresan una proteína que no es capaz de translocarse al núcleo para ejercer su función. Éste es el caso de la mutación Phe1263del, presente en un 20-30% de los casos. Un 20-50% de actividad reparadora del DNA parece ser suficiente para prevenir el fallo medular en pacientes con mutaciones hipomórficas, de forma que un fármaco capaz de conseguir un nivel mínimo de reparación podría proporcionar un importante beneficio clínico. Con el objetivo de descubrir este fármaco, hemos realizado un cribado de fármacos en un modelo celular con la mutación en FANCA, Phe1263del, que también expresa de forma estable la proteína fluorescente YFP-FANCD2. En ausencia de daño en el DNA, FANCD2 se localiza en el núcleo visualizándose como un marcaje difuso, mientras que al inducir daño se monoubiquitina y forma focos nucleares intensos. En esta línea celular, FANCL no es capaz de monoubiquitinar FANCD2 y YFP-FANCD2 se observa como un marcaje nuclear difuso. En una plataforma robótica de alto rendimiento hemos tratado esta línea celular y su control WT con 3947 fármacos aprobados por la FDA o en ensayos clínicos usando 2 dosis (100 nM and 1 µM), y hemos encontrado 2 aparentemente capaces de restablecer la formación de focos nucleares de YFP-FANCD2. Posteriormente, hemos realizado estudios funcionales para validar su eficacia y ninguno de ellos ha resultado ser capaz de inducir la monoubiquitinación de FANCD2 y reactivar la ruta. Este estudio muestra la capacidad potencial de realizar un cribado con una librería de compuestos más grande en células con mutaciones no truncadoras en FANCA.
COORDINA:
PARTICIPA:


