InMaM
Nuevas oportunidades inmunoterapéuticas en cáncer de mama metastásico: inhibidores de CDK4/6 y su impacto en el sistema inmunológico
LINEA DE ACTUACIÓN 2: IMPLEMENTACIÓN Y ANÁLISIS DE BASES DE DATOS EN MEDICINA DE PRECISIÓN
Línea de actuación complementaria: LA4. Desarrollo de modelos biológicos para cribado y estudio de la actividad de moléculas terapéuticas
Palabras clave: Cáncer de mama, respuesta inmune antitumoral, inhibidores de CDK4/6, biomarcadores predictivos.
Coordina: Institut de Recerca de la SIDA IrsiCaixa
Participa: Institut de Recerca Germans Trias i Pujol (IGTP) (Cataluña), Instituto de Investigación Sanitaria Biocruces Bizkaia (País Vasco)
Persona de contacto: Ester Ballana, PhD (eballana@iriscaixa.es)
RESUMEN PROYECTO
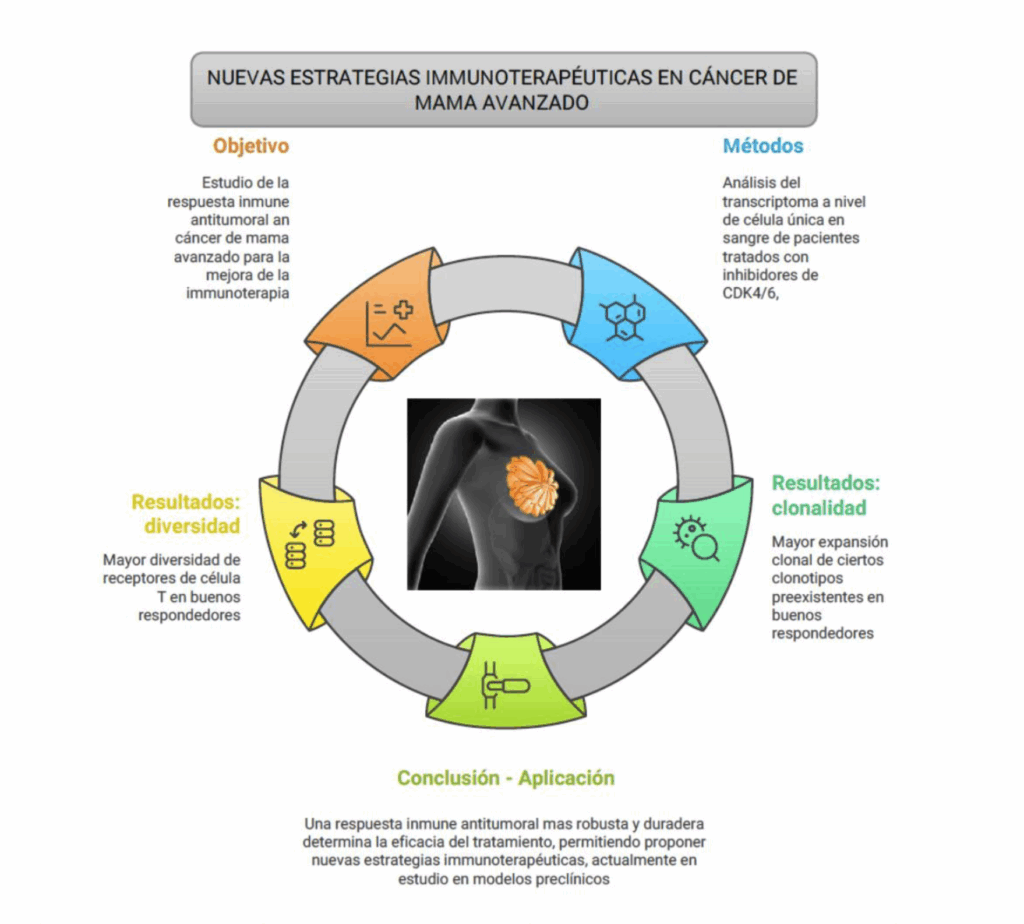
El tratamiento del cáncer de mama avanzado ha experimentado una revolución con la aprobación de una nueva clase de fármacos dirigidos a la función de CDK4/6. Evidencias crecientes indican que la respuesta inmune antitumoral representa un factor clave para determinar la eficacia de los inhibidores de CDK4/6, los cuáles tendrían propiedades inmunomoduladores de gran interés terapéutico.
El objetivo del proyecto es definir y caracterizar los mecanismos moleculares responsables de los efectos inmunomoduladores de los inhibidores de CDK4/6, con el objetivo final de proporcionar una base biológica para el desarrollo de biomarcadores de respuesta al tratamiento y nuevas estrategias inmunoterapéuticas. Con este fin, utilizaremos técnicas transcriptómicas de célula única para identificar y caracterizar el efecto del tratamiento con inhibidores de CDK4/6 sobre el sistema inmune y sus vías reguladoras in vivo. La caracterización en profundidad de la función inmunitaria periférica en una cohorte bien descrita de pacientes con cáncer de mama metastásico identificará biomarcadores putativos de la respuesta al tratamiento con inhibidores de CDK4/6, pero también tiene el potencial de sentar las bases para el control de la respuesta inmunitaria antitumoral en sangre. Además, el mayor conocimiento sobre las propiedades inmunomoduladoras de los inhibidores de CDK4/6 permitirá proponer nuevas estrategias inmunoterapéuticas que posteriormente se probarán en modelos celulares heterotípicos 3D, proporcionando una prueba de concepto preclínica de su eficacia y uso clínico putativo.
En resumen, esta propuesta contribuirá a una mejor comprensión de la complejidad del cáncer de mama, pero específicamente de las interacciones entre el tumor y las células inmunitarias del huésped. Resolver la interconexión entre el sistema inmune-tumor sin duda abrirá la Puerta a mejoras radicales en la terapia anticáncer.
mutaciones hipomórficas. Consecuentemente, un fármaco capaz de conseguir un nivel mínimo de reparación podría proporcionar un importante beneficio clínico.RESULTADOS DEL PROYECTO
Medicina de precisión para combatir la anemia de Fanconi La anemia de Fanconi es un trastorno genético raro causado por mutaciones en uno de los 23 genes Fanconi, que se caracteriza por fallo medular, malformaciones y predisposición al cáncer. La única cura de los síntomas hematológicos es el trasplante hematopoyético, aunque su supervivencia está limitada por complicaciones de éste y la aparición prematura de cáncer. Entre los pacientes con mutaciones en FANCA, muchos expresan una proteína que no es capaz de translocarse al núcleo para ejercer su función. Éste es el caso de la mutación Phe1263del, presente en un 20-30% de los casos. Un 20-50% de actividad reparadora del DNA parece ser suficiente para prevenir el fallo medular en pacientes con mutaciones hipomórficas, de forma que un fármaco capaz de conseguir un nivel mínimo de reparación podría proporcionar un importante beneficio clínico. Con el objetivo de descubrir este fármaco, hemos realizado un cribado de fármacos en un modelo celular con la mutación en FANCA, Phe1263del, que también expresa de forma estable la proteína fluorescente YFP-FANCD2. En ausencia de daño en el DNA, FANCD2 se localiza en el núcleo visualizándose como un marcaje difuso, mientras que al inducir daño se monoubiquitina y forma focos nucleares intensos. En esta línea celular, FANCL no es capaz de monoubiquitinar FANCD2 y YFP-FANCD2 se observa como un marcaje nuclear difuso. En una plataforma robótica de alto rendimiento hemos tratado esta línea celular y su control WT con 3947 fármacos aprobados por la FDA o en ensayos clínicos usando 2 dosis (100 nM and 1 µM), y hemos encontrado 2 aparentemente capaces de restablecer la formación de focos nucleares de YFP-FANCD2. Posteriormente, hemos realizado estudios funcionales para validar su eficacia y ninguno de ellos ha resultado ser capaz de inducir la monoubiquitinación de FANCD2 y reactivar la ruta. Este estudio muestra la capacidad potencial de realizar un cribado con una librería de compuestos más grande en células con mutaciones no truncadoras en FANCA.
COORDINA:
PARTICIPA:


